Протягом останніх років відбувся стрімкий прогрес у науці та медицині. На сьогодні накопичено багато даних, що істотно розширили розуміння розвитку різних захворювань, дозволили вдосконалити діагностику та лікування пацієнтів. Разом із появою нових методів діагностики та лікування виникла потреба у впровадженні принципово нового підходу до ведення хворого, у якому будуть враховуватися індивідуальні особливості людини. Настала ера персоналізованої медицини.
У рамках цьогорічного мультидисциплінарного конгресу з міжнародною участю «Рак у молодих пацієнтів – проблеми профілактики, скринінгу, лікування, реабілітації» експерт МОЗ України за спеціальністю «Онкологія», завідувач кафедри онкології ДУ «Запорізька медична академія післядипломної освіти МОЗ України», доктор медичних наук, професор Олексій Олексійович Ковальов одну із своїх доповідей присвятив персоналізованій онкології.

Олексій Олексійович Ковальов, експерт МОЗ України зі спеціальності «онкологія», професор, д.мед.н., завідувач кафедри онкології Запорізької медичної академії післядипломної освіти (МАПО)
Проблема резистентного раку виникла водночас із впровадженням перших цитостатичних препаратів. Вперше терапевтична резистентність до іфосфаміду була зареєстрована Густафом Ліндскогом, який для лікування пацієнта з лімфомою Ходжкіна використав іприт. Терапевтична резистентність може розвинутися також до таргетних засобів. У 2001 р. H. Joensuu описав клінічний випадок виникнення рецидиву хвороби у пацієнтки із гастроінтестинальною пухлиною через 10 міс після її регресування на тлі лікування іматинібом у зв’язку з резистентністю до лікування.
У 1984 р. була запропонована модель Goldie-Coldman, згідно з якою механізмом розвитку резистентності є спонтанний генетичний дефект. У кожній злоякісній пухлині міститься щонайменше один клон клітин, стійкий до дії ліків, що зумовлено наявністю певних мутацій. У міру збільшення маси пухлини підвищується вірогідність появи резистентного клону. Відповідно до закону Гомпертца щодо кінетики росту пухлини, резистентність раку залежить від об’єму клітинної маси, часу розвитку пухлини та кількості мутацій.
За аналогією теорії «великого вибуху» у Всесвіті, яка пояснює механізм його появи, у 2010 р. була висунута цікава теорія «великого вибуху» в онкології. Згідно з останньою теорією, проліферація, поділ однієї сингулярної клітини, у якій виникла мутація, продовжується розповсюдженням по всьому організму ракових клітин, у яких згодом виникають нові мутації. У зв’язку з цим передбачити характер росту пухлини неможливо (A. Sottoriva et al., 2015). У ході прогресування пухлини ракові клітини змінюють свою біологію, що супроводжується появою геномної нестабільності та геномного хаосу. Нестабільність геному є однією з 10 фундаментальних ознак раку, запропонованих Дугласом Ханаханом (2001) та Робертом Вейнбергом (2011). Базуючись на цьому факті, президент Американського товариства клінічної онкології (ASCO) George W. Sledge у 2011 р. зазначив, що через неможливість аналізувати геномний хаос резистентність раку до терапії може виявитися непереборною проблемою.
Розшифрування людського геному у 2003 р. істотно розширило межі медичної науки. З’явилися нові наукові напрями, такі як функціональна геноміка, транскриптоніка, протеоміка, метаболоміка, ліпідоміка, епігеноміка тощо. Завдяки бурхливому розвитку науки разом з морфологічними й імуногістохімічними характеристиками пухлини стало можливо визначити молекулярний «портрет» пухлини за допомогою низки інноваційних методів. Перспективним напрямом онкології є пошук онкогенів і генів-супресорів різних пухлин.
Виникнення раку пов’язане не лише з «поломками» в генах. Лауреат Нобелівської премії Пейтон Роуз (1966) зазначив, що для розвитку раку геномні зміни необхідні, але їх недостатньо. Вчені помиляються, коли розглядають рак винятково з позиції мутованих генів. Вивчення раку має проводитися з різних позицій.
Встановлено, що закони еволюції впливають на прогресування раку. Сьогодні онкологи у всьому світі намагаються вплинути на перебіг раку, який є надзвичайно складним еволюційним процесом, що розпочався близько 1 млрд років тому в період Metazoa. Найдавнішому онкогену c-Myc, відповідальному за розвиток найрізноманітніших злоякісних пухлин, понад 1 млрд років.
Виділяють дві стратегії розмноження живих організмів для підтримки чисельності виду: R- та K-стратегії. R-стратегія передбачає максимально швидкий ріст популяції за рахунок безперервної народжуваності (потомство не є довговічним), K-стратегія – відтворення малої кількості повноцінного потомства (C. Athena Aktipis et al., 2013). Швидка R-стратегія виживання ракових клітин спостерігається за умов дефіциту ресурсів і постійного впливу факторів навколишнього середовища (використання хіміотерапії, променевої терапії), що супроводжується конкуренцією між клонами. При цьому ракові клітини швидко проліферують і відтворюють численне, але дефектне покоління. Виснаження ресурсів призводить до міграції клітин (метастазування). Тобто ця тактика передбачає відмову від конкуренції та пошук нового мікрооточення для виживання та проліферації. Механізмами швидкої стратегії є відміна контрольних точок у клітинному циклі, скорочення фази G1, пригнічення репарації ДНК, метаболічне перепрограмування (гліколіз, швидка проліферація навіть в анаеробних умовах ацидозу), активація міграції (метастазування).
Повільна K-стратегія виживання ракових клітин реалізується у стабільних умовах і без загрози з боку факторів навколишнього середовища (відсутність впливу променевої чи хіміотерапії, достатня кількість кисню та глюкози). Вона характеризується появою клонів, що повільно ростуть та є стійкими до екологічного стресу (резистентність). Механізмами повільної стратегії є пригнічення апоптозу та виживання, підвищення репарації ДНК, аутофагія як прояв стійкості до стресу клітини, ремоделювання власного мікрооточення, пригнічення активних форм кисню та вільних радикалів, ефективне використання поживних речовин за рахунок окисного фосфорилювання, посилення активності АВС- транспортерів. Тобто неправильно вважати, що ракова клітина постійно проліферує, оскільки існують етапи повільного та швидкого росту пухлин, це слід враховувати при проведенні протипухлинної терапії (C. Athena Aktipis et al., 2013).
Розуміння загальних механізмів масового вимирання біологічних видів може стати помічним у розробленні нових принципів терапії раку. Слід зазначити, що 99,9% біологічних видів, які заселяли планету Земля, вимерли. Це відбувалося у результаті фонового (постійний спонтанний процес, що призводить до поступової заміни одних видів іншими) та раптового масового вимирання (за всю історію Землі було 5 епізодів раптового вимирання живих істот). Вивчення біологічних видів, що вижили, має важливе значення для науки, у тому числі онкології. Так, для біологічних видів, які вижили, характерні велика чисельність популяції, короткий період відтворення потомства, велика швидкість росту, велике внутрішньовидове розмаїття, здатність до міграції, широкий ареол проживання, здатність використовувати різноманітні ресурси. Цей перелік ознак можна застосувати і для опису ракових клітин. Принципи раптового вимирання видів аналогічні деяким типам терапії раку. Наприклад, зменшення чисельності популяції є аналогом впливу хіміотерапії, променевої терапії, хірургічного втручання, винищення видів паразитами – терапії онколітичними вірусами, зміни клімату – гіпертермії, зміни рН в пухлині, дієти, руйнування середовища – антиангіогенної терапії, впливу на пухлиноасоційовані фібробласти, обмеження поживних речовин, безперервної стресової дії – метрономної терапії, вплив різних стресових факторів – комбінованого та комплексного лікування, вибіркова селективна дія – персоналізованої таргетної терапії. Варто зазначити, що дія більшості стресових факторів не була спрямована на вид, який пізніше зник, а на навколишнє середовище. Якщо проводити аналогії з протипухлинним лікуванням, то мішенню терапії має бути не сама ракова клітина, а її мікрооточення.
Завдяки сучасним досягненням науки у всьому світі активно впроваджується персоналізована (індивідуальна, тейлорна, передбачувальна, інтегральна, геномна, фармакогеномна, агностична) медицина. Однак разом із новою стратегією постала низка запитань. Наприклад, чому деякі мутації ініціюють канцерогенез в одних тканинах, а в інших – ні? Яким чином визначити онкогенні мутації у пухлинах із величезною кількістю мутацій? Чому при застосуванні певного препарату при одній і тій же мутації, але у пацієнтів з різними пухлинами, ефект є різним (наприклад анти-BRAF терапія вемурафенібом ефективна при меланомі з mBRAF, але неефективна при колоректальному раку з mBRAF)? Якому лікуванню слід віддавати перевагу: стандартизованому з високим рівнем доказовості чи персоналізованому з меншим рівнем доказовості, але яке потенційно може забезпечити кращий результат у конкретного пацієнта? Чи призначати терапію за наявності невідомих мутацій при відсутності клінічних доказів на користь її ефективності?
Основним недоліком персоналізованої терапії раку є те, що вона поки не торкається проблеми токсичності. Основним критерієм, що впливає на токсичність протипухлинного препарату, є дозування. На початку лікування збільшення дози цитостатика призводить до лінійного підвищення ефективності терапії, однак надалі відбувається вихід на плато, вище якого збільшення дози не призводить до підвищення ефективності (рис.). Ескалація дози цитостатика асоційована зі збільшенням витрат на лікування, підвищенням токсичності та негативним впливом на якість життя пацієнта (W. Hryniuk et al., 1998). Зниження дози цитостатика зменшує й ефективність терапії: зниження дози на 20% від запланованої погіршує результати ад’ювантної терапії на 50%, а при отриманні дози, меншої за 65% від запланованої, рівень виживаності такий самий, як за відсутності ад’ювантної терапії (G. Bonadonna et al., 1995). У цій ситуації необхідний персоналізований підхід, застосування правильної дози правильних у конкретних ситуаціях ліків – компаундингу (з англ. compounding – сполучати, змішувати). Термін «компаундинг» означає створення фармацевтичного продукту з урахуванням індивідуальних особливостей окремого пацієнта. Компаундинг є обов’язковою складовою терапії у всіх онкологічних клініках. Основною перевагою такого підходу для пацієнта є точність дозування ліків без підвищення вартості лікування.
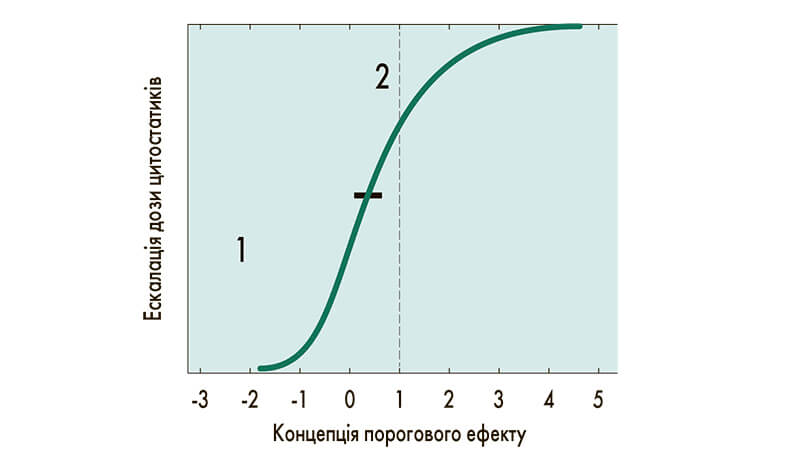
Рис. Залежність між дозою цитостатика й ефективністю лікування
В Україні компаундинг представлений у центрі «Хемотека». Перевагами центру є виключення суб’єктивних та об’єктивних причин зниження або підвищення дози цитостатика як у державних, так і в приватних онкологічних клініках. Рецепти на препарати виписуються в онлайн-режимі. Індивідуально виготовлений препарат у готовій для введення формі доставляється в клініку. У процесі приготування розчинів відсутні будь-які ризики для медичного персоналу. Для реалізації фармацевтичного компаундингу необхідні фармацевтичний завод або лабораторія, асептичні бокси для приготування препаратів, спеціальна система контролю безпеки персоналу, обладнання для високої точності дозування, контроль якості зберігання субстанцій і готових препаратів, контроль температурного режиму, особливі умови для транспортування.
Постгеномна медицина не обмежується лише персоналізованим лікуванням. Сьогодні у всьому світі впроваджується стратегія 4П, запропонована Лероєм Худом. Сучасна медицини повинна бути профілактичною, предиктивною, партисипативною, персоналізованою. Варто зазначити, що навіть у профілактиці раку можливе застосування персоналізованого підходу, зокрема за допомогою генетичного скринінгу. Наприклад, відома американська актриса Анджеліна Джолі, у якої була виявлена мутація BRCA, прийняла рішення щодо проведення білатеральної мастектомії з подальшим протезуванням молочних залоз із метою усунення органа-мішені та зниження ризику розвитку раку.
Однак сьогодні відомо, що гени BRCA1 та BRCA2 відповідальні лише за 20% усіх випадків спадкового раку, а за решту 80% випадків – інші гени (TP53, PTEN, STK11, CDH1, PALB2, CHEK2, ATM, NBN, BARD1, BRIP1, RAD51C; H.T. Lynch et al., 1990). Ці гени характеризуються різним ступенем пенетрантності, і кожен з них відповідає за розвиток спадкового раку не однієї, а різних локалізацій. Наприклад, BRCA1-синдром пов’язаний із розвитком раку молочної залози, яєчника, простати, підшлункової залози, BRCA2-синдром – із раком молочної та підшлункової залози, CHEK2- синдром – із раком молочної залози та гастроінтестинальним раком тощо. На початку ХХ століття Альфред-Скот Вартінг виявив сім’ю, надалі називаючи її сім’єю G, у різних поколіннях якої спостерігалися численні випадки неполіпозного раку товстої кишки й ендометрія. Генрі Лінч продовжив спостереження за цією сім’єю, і згодом спадковий неполіпозний рак товстої кишки й ендометрія отримав назву синдрому Лінча.
Таким чином, генетичне тестування є однією зі складових персоналізованої онкології. Генетичне тестування необхідно проводити онкологічним пацієнтам для визначення ризику розвитку раку в іншому органі (яєчнику, матці, кишечнику), уточнення ризику можливого рецидиву, проведення персоналізованої терапії, а також здоровим носіям мутантного гена з метою встановлення ризику виникнення спадкового раку, профілактики раку за наявності онкогенної мутації (спостереження, оперативне втручання), первинної профілактики раку у майбутніх дітей (прегестаційна та пренатальна діагностика). Значною перевагою сучасного генетичного тестування є можливість використання повної панелі генів, що дозволяє за одне дослідження одразу виявити кілька мутацій. Генетичне тестування має низку особливостей: результат не змінюється протягом життя, його можна проводити ще до народження дитини, генетичні аномалії наявні задовго до появи клінічних симптомів раку, мутації є у всіх членів сім’ї, тому їх можна відслідкувати у родичів. ДНК є дуже стабільною, тому її можна досліджувати в збереженому матеріалі навіть після смерті людини. Генетичне тестування слід проводити тільки в рамках генетичного консультування.
Геномні зміни мають велике значення у розвитку раку, однак не слід виключати і зовнішні фактори, спосіб життя людини.
У постгеномну еру світ переживає науковий вибух. Однак перехід від фундаментальної науки до практичних технологій рідко є лінійним. Сьогодні доступно значно більше даних, ніж ми можемо знайти їм практичне застосування. Інтерпретація даних молекулярної генетики і способи доведення її цінності для пацієнта та системи охорони здоров’я залишаються найбільш актуальними проблемами сучасної онкології.