За последние годы произошел стремительный прогресс в науке и медицине. На сегодняшний день накоплено множество данных, которые существенно расширили понимание развития различных заболеваний, позволили усовершенствовать диагностику и лечение пациентов. Вместе с появлением новых методов диагностики и лечения возникла потребность во внедрении принципиально нового подхода к ведению больного с учетом индивидуальных особенностей человека. Наступила эра персонализированной медицины.
В рамках мультидисциплинарного конгресса с международным участием «Рак у молодых пациентов - проблемы профилактики, скрининга, лечения, реабилитации» эксперт МЗО Украины по специальности «Онкология», заведующий кафедрой онкологии ГУ «Запорожская медицинская академия последипломного образования МЗО Украины», доктор медицинских наук, профессор Алексей Алексеевич Ковалев один из своих докладов посвятил персонализированной онкологии.

Алексей Алексеевич Ковалёв, эксперт Минздрава Украины по специальности «онкология», профессор, д.мед.н., заведующий кафедрой онкологии Запорожской медицинской академии последипломного образования (МАПО)
Проблема резистентности рака возникла одновременно с внедрением первых цитостатических препаратов. Впервые терапевтическая резистентность к ифосфамиду была зарегистрирована Густафом Линдскогом, который для лечения пациента с лимфомой Ходжкина использовал иприт. Терапевтическая резистентность может развиться также к таргетным средствам. В 2001 г.. H. Joensuu описал клинический случай возникновения рецидива болезни у пациентки с гастроинтестинальной опухолью через 10 мес. после ее регрессирования на фоне лечения иматинибом в связи с резистентностью к терапии.
В 1984 г. была предложена модель Goldie-Coldman, согласно которой механизмом развития резистентности является спонтанный генетический дефект. В каждой злокачественной опухоли содержится по меньшей мере один клон клеток, устойчивых к действию лекарств, что обусловлено наличием определенных мутаций. По мере увеличения массы опухоли повышается вероятность появления резистентного клона. Согласно закону Гомпертца, что касается кинетики роста опухоли, резистентность рака зависит от объема клеточной массы, времени развития опухоли и количества мутаций.
По аналогии с теорией «большого взрыва» во Вселенной, которая объясняет механизм его появления, в 2010 г. Была выдвинута интересная теория «большого взрыва» в онкологии. Согласно последней теории, пролиферация, деление одной сингулярной клетки, в которой возникла мутация, продолжается распространением по всему организму раковых клеток, в которых впоследствии возникают новые мутации. В связи с этим предусмотреть характер роста опухоли невозможно (A. Sottoriva et al., 2015). В ходе прогрессирования опухоли раковые клетки меняют свою биологию, чтот сопровождается появлением геномной нестабильности и геномного хаоса. Нестабильность генома является одной из 10 фундаментальных признаков рака, предложенных Дугласом Ханаханом (2001) и Робертом Вейнбергом (2011). Основываясь на этом факте, президент Американского общества клинической онкологии (ASCO) George W. Sledge в 2011 г. отметил, что из-за невозможности анализировать геномный хаос резистентность рака к терапии может оказаться непреодолимой проблемой.
Расшифровка человеческого генома в 2003 г. существенно расширила границы медицинской науки. Появились новые научные направления, такие как функциональная геномика, транскриптомика, протеомика, метаболомика, липидомика, епигеномика, тому подобное. Благодаря бурному развитию науки вместе с морфологическими и имуногистохимическими характеристиками опухоли стало возможным определение молекулярного «портрета» опухоли с помощью ряда инновационных методов. Перспективным направлением онкологии является поиск онкогенов и генов-супрессоров различных опухолей.
Возникновение рака связано не только с «поломками» в генах. Лауреат Нобелевской премии Пейтон Роуз (1966) отметил, что для развития рака геномные изменения необходимы, но их недостаточно. Ученые ошибаются, когда рассматривают рак исключительно с позиции мутировавших генов. Изучение рака должно проводиться с разных позиций.
Установлено, что законы эволюции влияют на прогрессирование рака. На сегодняшний день онкологи во всем мире пытаются повлиять на течение рака, который является чрезвычайно сложным эволюционным процессом, начавшимся около 1 млрд лет назад в период Metazoa. Древнейшему онкогену c-Myc, ответственному за развитие самых злокачественных опухолей, более 1 млрд лет.
Выделяют две стратегии размножения живых организмов для поддержания численности вида: R- и K-стратегии. R-стратегия предполагает максимально быстрый рост популяции за счет непрерывной рождаемости (потомство не является долговечным), K-стратегия - воспроизведение малого количества полноценного потомства (C. Athena Aktipis et al., 2013). Быстрая R-стратегия выживания раковых клеток наблюдается в условиях дефицита ресурсов и постоянного воздействия факторов окружающей среды (использование химиотерапии, лучевой терапии), что сопровождается конкуренцией между клонами. При этом раковые клетки быстро пролиферируют и воспроизводят многочисленные, но дефектные поколения. Истощение ресурсов приводит к миграции клеток (метастазирование). Тоесть эта тактика предусматривает отказ от конкуренции и поиск нового микроокружения для выживания и пролиферации. Механизмами быстрой стратегии являются отмена контрольных точек в клеточном цикле, сокращение фазы G1, угнетение репарации ДНК, метаболическое перепрограммирование (гликолиз, быстрая пролиферация даже в анаэробных условиях ацидоза), активация миграции (метастазирование).
Медленная K-стратегия выживания раковых клеток реализуется в стабильных условиях и без угрозы со стороны факторов окружающей среды (отсутствие влияния лучевой или химиотерапии, достаточное количество кислорода и глюкозы). Она характеризуется появлением клонов, которые медленно растут и устойчивы к екологическому стрессу (резистентность). Механизмами медленной стратегии являются подавление апоптоза и выживание, повышение репарации ДНК, аутофагия, как проявление устойчивости к стрессу клетки, ремоделирование собственного микроокружения, угнетение активных форм кислорода и свободных радикалов, эффективное использование питательных веществ за счет окислительного фосфорилирования, усиление активности АВС транспортеров.
Тоесть неправильно считать, что раковая клетка постоянно пролиферирует, поскольку существуют этапы медленного и быстрого роста опухолей, это следует учитывать при проведении противоопухолевой терапии (C. Athena Aktipis et al., 2013).
Понимание общих механизмов массового вымирания биологических видов может стать вспомогательным в разработке новых принципов терапии рака. Следует отметить, что 99,9% биологических видов, заселявших планету Земля, вымерли. Это происходило в результате фонового (постоянный спонтанный процесс, который приводит к постепенной замене одних видов другими) и внезапного массового вымирания (за всю историю Земли было 5 эпизодов внезапного вымирания живых существ). Изучение выживших биологических видов имеет важное значение для науки, в том числе онкологии. Так, для биологических видов, которые выжили, характерны большая численность популяции, короткий период воспроизводства потомства, большая скорость роста, значительное внутривидовое разнообразие, способность к миграции, широкий ареол обитания, способность использовать различные ресурсы. Этот перечень признаков можно использовать и для описания раковых клеток. Принципы внезапного вымирания видов аналогичны некоторым типам терапии рака. Например, уменьшение численности популяции является аналогом влияния химиотерапии, лучевой терапии, хирургического вмешательства, уничтожение видов паразитами - терапии онколитических вирусами, изменения климата - гипертермии, изменения рН в опухоли, диеты, разрушение среды - антиангиогенной терапии, воздействия на опухольассоциированные фибробласты, ограничения питательных веществ, непрерывное стрессовое влияние - метрономной терапии, влияние различных стрессовых факторов - комбинированного и комплексного лечения, выборочное селективное действие - персонализированной таргетной терапии. Стоит отметить, что действие большинства стрессовых факторов было направлено не на вид, который позже исчез, а на окружающую среду. Если проводить аналогии с противоопухолевым лечением, то мишенью терапии должна быть не сама раковая клетка, а ее микроокружение.
Благодаря современным достижениям науки во всем мире активно внедряется персонализированная (индивидуальная, тейлорная, предсказательная, интегральная, геномная, фармакогеномная, агностическая) медицина. Однако, вместе с новой стратегией, возник ряд вопросов. Например, почему некоторые мутации инициируют канцерогенез в одних тканях, а в других - нет? Каким образом определить онкогенные мутации в опухолях с огромным количеством мутаций? Почему при применении определенного препарата при одной и той же мутации, но у пациентов с разными опухолями, эффект различен (например, анти-BRAF терапия вемурафенибом эффективна при меланоме с mBRAF, но неэффективна при колоректальном раке с mBRAF)? Какому лечению следует отдать предпочтение: стандартизированному с высоким уровнем доказательности или персонализированному с меньшим уровнем доказательности, но которое потенциально может обеспечить лучший результат у конкретного пациента? Или назначать терапию при наличии неизвестных мутаций при отсутствии клинических доказательств в пользу ее эффективности?
Основным недостатком персонализированной терапии рака является то, что она пока не касается проблемы токсичности. Основным критерием, влияющим на токсичность противоопухолевого препарата, является дозировка. В начале лечения увеличение дозы цитостатика приводит к линейному повышению эффективности терапии, однако, в дальнейшем происходит выход на плато, выше которого увеличение дозы не приводит к повышению эффективности (рис.). Эскалация дозы цитостатика ассоциирована с увеличением расходов на лечение, повышением токсичности и негативным влиянием на качество жизни пациента (W. Hryniuk et al., 1998). Снижение дозы цитостатика уменьшает и эффективность терапии: снижение дозы на 20% от запланированной ухудшает результаты адъювантной терапии на 50%, а при получении дозы, меньше 65% от запланированной, уровень выживаемости такой же, как и при полном отсутствии адъювантной терапии (G. Bonadonna et al., 1995). В этой ситуации необходим персонализированный подход, применение правильной дозы, правильных в конкретных ситуациях лекарств - компаундинга (с англ. Compounding - соединять, смешивать).
Термин «компаундинг» означает создание лекарственного препарата с учетом индивидуальных особенностей каждого конкретного пациента. Компаундинг является обязательной составляющей терапии во всех онкологических клиниках. Основным преимуществом такого подхода для пациента является точность дозирования лекарств без повышения стоимости лечения.
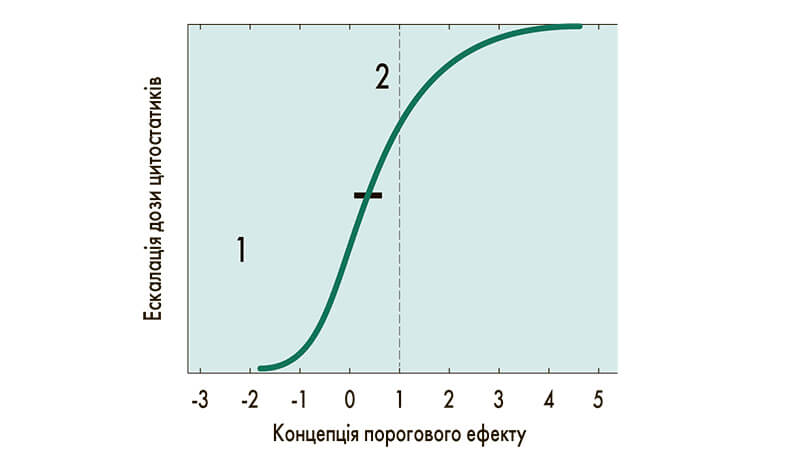
Рис. Зависимость между дозой цитостатика и эффективностью лечения
В Украине компаундинг представлен в центре персонализиированной фармации «Хемотека». Преимуществами центра являются исключение субъективных и обьективных причин снижения или повышения дозы цитостатика как в государственных, так и в частных онкологических клиниках. Рецепты на препараты выписываются в онлайн-режиме. Индивидуально изготовленный препарат в готовой для введения форме доставляется в клинику. В процессе приготовления растворов исключаются какие-либо риски для медицинского персонала. Для реализации фармацевтического компаундинга необходимы фармацевтический завод или лаборатория, асептические боксы для приготовления препаратов, специальная система контроля безопасности персонала, оборудование для высокой точности дозирования, контроль качества хранения субстанций и готових препаратов, контроль температурного режима, особые условия для транспортировки.
Постгеномна медицина не ограничивается только персонализированным лечением. Сегодня во всем мире внедряется стратегия 4П, предложенная Лероем Худом. Современная медицина должна быть профилактической, предиктивной, партисипативной, персонализированной. Стоит отметить, что даже в профилактике рака возможно применение персонализированного подхода, в частности, с помощью генетического скрининга. Например, известная американская актриса Анджелина Джоли, у которой была обнаружена мутация BRCA, приняла решение о проведении билатеральной мастэктомии с последующим протезированием молочных желез с целью устранения органа-мишени и снижения риска развития рака.
Однако, сегодня известно, что гены BRCA1 и BRCA2 ответственны только за 20% всех случаев наследственного рака, а за остальные 80% случаев - другие гены (TP53, PTEN, STK11, CDH1, PALB2, CHEK2, ATM, NBN, BARD1, BRIP1, RAD51C ; HT Lynch et al., 1990). Эти гены характеризуются разной степенью пенетрантности, и каждый из них отвечает за развитие наследственного рака не одной, а разных локализаций. Например, BRCA1-синдром связан с развитием рака молочной железы, яичника, простаты, поджелудочной железы, BRCA2-синдром - с раком молочной и поджелудочной железы, CHEK2- синдром - с раком молочной железы и гастроинтестинальным раком и тому подобное. В начале ХХ века Альфред-Скотт Вартинг выявил семью, в дальнейшем называя ее семьей G, в разных поколениях которой наблюдались многочисленные случаи неполипозного рака толстой кишки и эндометрия. Генри Линч продолжил наблюдение за этой семьей, и впоследствии наследственный неполипозный рак толстой кишки и эндометрия получил название синдрома Линча.
Таким образом, генетическое тестирование является одной из составляющих персонализированной онкологии. Генетическое тестирование необходимо проводить онкологическим пациентам для определения риска развития рака в другом органе (яичнике, матке, кишечнике), уточнения риска возможного рецидива, проведения персонализированной терапии, а также здоровым носителям мутантного гена с целью установления риска возникновения наследственного рака, профилактики рака при наличии онкогенной мутации (наблюдение, оперативное вмешательство), первичной профилактики рака у будущих детей (прегестационная и пренатальная диагностика). Значительным преимуществом современного генетического тестирования является возможность использования полной панели генов, что позволяет за одно исследование сразу выявить несколько мутаций. Генетическое тестирование имеет ряд особенностей: результат не меняется в течение жизни, его можно проводить еще до рождения ребенка, генетические аномалии имеются задолго до появления клинических симптомов рака, мутации есть у всех членов семьи, поэтому их можно отследить у родственников. ДНК является стабильной, поэтому ее можно исследовать в сохраненном материале даже после смерти человека. Генетическое тестирование следует проводить только в рамках генетического консультирования.
Геномные изменения имеют большое значение в развитии рака, однако не следует исключать и внешние факторы, образ жизни человека.
В постгеномную эру мир переживает научный взрыв. Однако переход от фундаментальной науки к практическим технологиям редко является линейным. Сегодня доступно гораздо больше данных, чем мы можем найти им практическое применение. Интерпретация данных молекулярной генетики и способы доведения ее ценности для пациента и системы здравоохранения остаются наиболее актуальными проблемами современной онкологии.